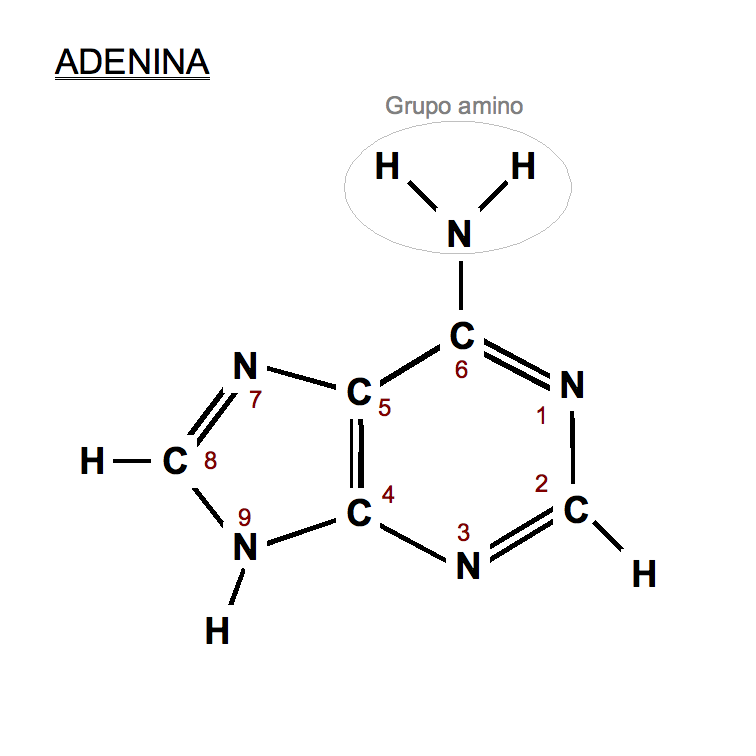
ESTRUCTURA: Fórmula desarrollada
INTRODUCCION
La molécula orgánica que he elegido es la adenina, una de las cinco bases nitrogenadas que forman parte de los ácidos nucléicos (ADN Y ARN) y en el código genético se representa con la letra A.
En el ADN la adenina siempre se empareja con la timina (T).Es un derivado de la purina (que es una base púrica) en la que un hidrógeno ha sido sustituido por un grupo amino (NH2).Al igual que la guanina, la citosina, la timina y el uracilo (todas bases nitrogenadas), forma parte de los nucleótidos que constituyen las largas cadenas de ácidos nucleicos; cada nucleótido está formado por un gupo fosfato, un azúcar de cinco carbonos (ribosa o desoxirribosa) y una de estas bases.
La adenina fue descubierta en 1885 por el bioquímico alemán Albrecht Kossel.
FUNCION
Desde el punto de vista químico, los ácidos nucleicos (adenina) son macromoléculas formadas por polímeros lineales de nucleótidos, unidos por enlaces ésteres de fosfato, sin periodicidad aparente.
Son las moléculas que tienen la información genética de los organismos y son las responsables de su transmisión hereditaria, de ahí su importancia. El conocimiento de la estructura de los ácidos nucleicos permitió la elucidación del código génetico, la determinación del mecanismo y control de la síntesis de proteínas y el mecanismo de transmisión de la información genética de la célula madre a las células hijas. Son planas, lo cual es importante en la estructura de los ácidos nucleicos, y esto se debe a que son aromáticas.
PROPIEDADES GENERALES
- Nombre: Adenina
- Nombre IUPAC: 7H-purina-6-amina
- Fórmula: C5H5N5
- Masa molecular: 135.1267 g/mol
- Punto de fusión: > 300ºC (573K)
La Tª de fusión indica la Tª a la que la mitad de las moléculas están desnaturalizadas.
El proceso: se aplica calor a la molécula y se mide la absorbancia a 260nm, progresivamente se va aumentando la Tª hasta llegar al punto medio, que será en el que se da la Tª de fusión. Si la Tª de fusión es alta significa que hay más enlaces del tipo A-T y si es baja que existe menos enlaces de este tipo; por lo que conseguiremos saber él % del enlace A-T.
- Abreviatura: A
- Son insolubles en agua y pueden establecer interacciones hidrófobas entre ellas; estas interacciones sirven para estabilizar la estructura tridimensional de los ácidos nucleicos. Las bases nitrogenadas absorben luz en el rango ultravioleta (250-280 nm), propiedad que se usa para su estudio y cuantificación.
PROPIEDADES FISICO-QUIMICAS
Desnaturalización: la proporción Adenina+Timina está relacionada en primer lugar con la estabilidad de la molécula de ADN de doble hélice. Cuanto mayor es el contenido en A+T de una molécula, mayor cantidad de pares A-T presentará, como consecuencia tendrá una mayor cantidad de triples enlaces y, por consiguiente, será necesario suministrar una mayor cantidad de energía a esa doble hélice para separar sus dos hebras (desnaturalización o fusión del ADN). Cuanto mayor es el contenido en A+T mayor cantidad de calor que hay que suministrar a un ADN de doble hélice para desnaturalizarlo. La temperatura de fusión (Tm) necesaria para desnaturalizar la mitad del ADN de una mezcla (punto medio de la reacción ADN doble hélice ® ADN hélice sencilla) esta directamente relacionada con el contenido en A+T, a mayor contenido en A+T mayor temperatura de fusión (Tm).
Absorbancia a 2.600 Å: El estado físico de los ácidos nucleicos está relacionado con su capacidad de absorción de la luz ultravioleta (UV) a 2.600 Å. El menor grado de absorción se produce en estado de doble hélice, la absorción aumenta cuando se produce la desnaturalización pasando a estado de hélice sencilla (efecto hipercrómico, aumento de la absorbancia) y, por último, si degradamos este ADN de hélice sencilla a nivel de nucleótidos libres, de nuevo aumenta la absorbancia.
Reabsorción: emparejamiento de las cadenas tras quitar el calor al que son sometidas para la desnaturalización.
Hibridación: emparejamiento entre cadenas coplementarias de origen diferente.