DEFINICIÓN:
Un semiconductor es un elemento que se comporta como un conductor o como aislante dependiendo de diversos factores, como por ejemplo el campo eléctrico o magnético, la presión, la radiación que le incide, o la temperatura del ambiente en el que se encuentre. Los semiconductores son materiales que con respecto a la conductividad eléctrica, se hallan entre los materiales aislantes y metales. Los elementos químicos semiconductores de la tabla periódica son: Cadmio (Cd), Aluminio (Al), Galio (Ga), Boro (B), Indio (In), Silicio (Si), Carbono (C), Germanio (Ge), Fósforo (P), Arsénico (As), Antimonio (Sb), Selenio (Se), Teluro (Te) y Azufre (S).
La característica común a todos ellos es que son tetravalentes, es decir, forman 4 enlaces covalentes.
* Podemos distinguir 4 tipos de semiconductores: intrínsecos, extrínsecos, de tipo N, y de tipo P.
PROPIEDADES:
Una propiedad importante en los semiconductores es que posibilita el poder modificar su resistividad de manera controlada entre márgenes muy amplios. La razón primera de este comportamiento diferente reside en su estructura atómica, básicamente en la distancia interatómica de sus átomos en la red así como el tipo de enlace entre ellos.
Así, el enlace atómico depende del número de electrones de valencia de los átomos formantes del enlace y de la electronegatividad de los mismos. Los electrones de la capa externa o electrones de valencia son los que determinan y forman los enlaces y los que en su momento pueden determinar el carácter conductivo o no de él.
En un semiconductor formado por dos elementos químicos diferentes (Arseniuro de Galio) la asimetría conlleva en general una cierta pérdida de carácter covalente puro, en el sentido de desplazar el centro de gravedad de la carga hacia uno u otro átomo. El parámetro que determina este desplazamiento es la electronegatividad de los átomos constituyentes. Cuanto más diferente sea, mayor será el desplazamiento y el enlace será más iónico que covalente.
La estructura cristalina de los semiconductores es en general compleja aunque puede visualizarse mediante superposición de estructuras más sencillas. La estructura más común es la del diamante, común a los semiconductores Si y Ge, y la del Zinc-Blenda que es la del Arseniuro de Galio. En estas redes cristalinas cada átomo se encuentra unido a otros cuatro mediante enlaces covalentes con simetría tetraédrica. Se requiere que posean unas estructuras cristalinas únicas, es decir, que sea monocristal. Dependiendo de cómo se obtengan éste puede presentarse en forma de monocristal, policristal y amorfo.
El comportamiento eléctrico de los materiales semiconductores (resistividad y movilidad) así como su funcionamiento depende de la estructura cristalina del material de base, siendo imprescindible la forma monocristalina cuando se requiere la fabricación de circuitos integrados y dispositivos electroópticos (láser, leds).
En lo referente al transporte de carga en semiconductores el fenómeno de las colisiones de los portadores con otros portadores, núcleos, iónes y vibraciones de la red, disminuye la movilidad. Ello guarda relación con el parametro de la resistividad (o conductividad) definido como la facilidad para la conducción eléctrica, depende intrínsecamente del material en cuestión y no de su geometria. Así pues en los fenómenos detransporte en semiconductores y a diferencia de los metales, la conducción se debe a dos tipos de portadores, huecos y electrones.
JUSTIFICACIÓN DEL ENLACE POR TEORÍA DE BANDAS:
La teoría de bandas constituye una explicación alternativa del comportamiento de los materiales semiconductores. Se basa en el hecho de que los electrones de un átomo aislado se distribuyen según ciertos niveles energéticos, denominados órbitas u orbitales, en torno al núcleo. Cuando los átomos se unen unos con otros para formar un sólido, se agrupan de manera ordenada formando una red cristalina. En este caso, debido a la proximidad de los átomos entre sí, las órbitas en las que se encuentran los electrones de cada átomo se ven afectadas por la presencia de los átomos vecinos. De hecho, dichas órbitas se solapan entre sí, dando lugar a la aparición de unas zonas o bandas continuas en las que se pueden encontrar los electrones, y que reciben el nombre de bandas de energía.
Para entender el comportamiento de los materiales en relación con su capacidad de conducir, nos interesan las dos últimas bandas, que son:
La banda de valencia: está ocupada por los electrones de valencia de los átomos, es decir, aquellos electrones que se encuentran en la última capa o nivel energético de los átomos. Los electrones de valencia son los que forman los enlaces entre los átomos, pero no intervienen en la conducción eléctrica.
La banda de conducción: está ocupada por los electrones libres, es decir, aquellos que se han desligado de sus átomos y pueden moverse fácilmente. Estos electrones son los responsables de conducir la corriente eléctrica.
En consecuencia, para que un material sea buen conductor de la corriente eléctrica debe tener electrones en la banda de conducción. Cuando la banda esté vacía, el material se comportará como un aislante.
Entre la banda de valencia y la de conducción existe una zona denominada banda prohibida o gap, que separa ambas bandas y en la cual no pueden encontrarse los electrones.
La conducción de la corriente eléctrica según la teoría de bandas
La estructura de bandas de un material permite explicar su capacidad para conducir o no la corriente eléctrica. Según esto podemos distinguir tres casos, representados en las figuras adjuntas.
En los materiales conductores, las bandas se encuentran muy próximas y la banda de conducción está ocupada por electrones libres, desligados de sus átomos, que pueden moverse fácilmente y pasar de unos átomos a otros. Este tipo de estructura de bandas corresponde a materiales que pueden conducir la corriente eléctrica.
Sin embargo, en los materiales aislantes la banda de conducción se encuentra vacía, pues no hay electrones libres, de modo que no pueden conducir la corriente eléctrica. La banda que está ocupada en este caso es la banda de valencia, pero estos electrones no pueden moverse libremente.
Los materiales semiconductores tienen una estructura de bandas semejante a la de los aislantes, es decir, la banda de conducción está vacía (y, en consecuencia, no conducen la corriente eléctrica). Sin embargo, en este caso la banda prohibida es muy estrecha, de forma que la banda de valencia se encuentra muy próxima a la de conducción.
Esta situación permite que, si se comunica una pequeña cantidad de energía al material, algunos electrones de la banda de valencia puedan «saltar» a la de conducción, lo que quiere decir que se desligan de sus átomos y se hacen libres. Al tener ocupada la banda de conducción, el material se comportará como conductor.
ADICION DE DOPANTES, EFECTO PRODUCIDO Y TIPOS
En la producción de semiconductores, se denomina dopaje al proceso intencional de agregar impurezas en un semiconductor extremadamente puro con el fin de cambiar sus propiedades eléctricas. Las impurezas utilizadas dependen del tipo de semiconductores a dopar. A los semiconductores con dopajes ligeros y moderados se los conoce como extrínsecos. Un semiconductor altamente dopado, que actúa más como un conductor que como un semiconductor, es llamado degenerado.
Tipo N
Cuando se introducen sustancias dopantes de tipo pentavalente (5 electrones de valencia), entonces cuatro átomos de las sustancias dopantes formarán enlaces covalentes con los átomos de Si, el quinto electrón que no comparte enlaces, es un electrón de conducción el cual será donado a la banda de conducción. Entonces diremos que el semiconductor de Si es de tipo N debido a que recibe una cantidad adicional de portadores de carga negativa y la sustancia pentavalente (P, As, Sb) se llama donador.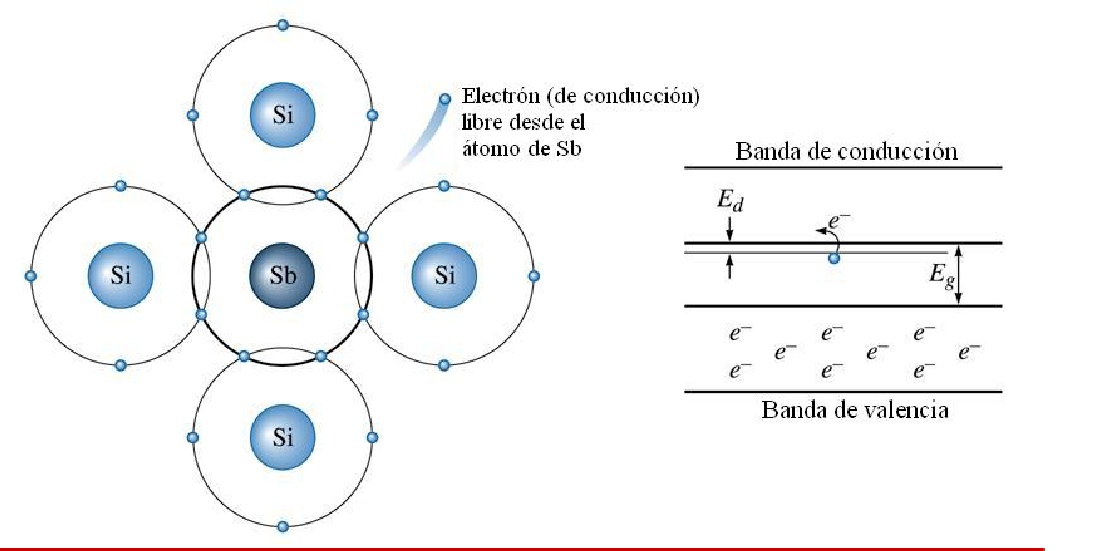
Tipo P
De manera similar, si introducen en la red de Si. Impurezas de tipo trivalente (tres electrones de valencia), aparece un enlace covalente con el resto de los átomos de Si. Sin formar, entonces es un enlace roto o una ausencia del electrón de valencia para llevar enlace. Esta deficiencia de electrón en los enlaces que puede formar el átomo trivalente provoca que sea aceptado un electrón de los enlaces covalente de los átomos de Si. Formándose en consecuencia hueco en la banda de valencia. El semiconductor dopado con sustancias triviales se llama de tipo P y dichas sutancias (B, Al, Ga) se denominan aceptores.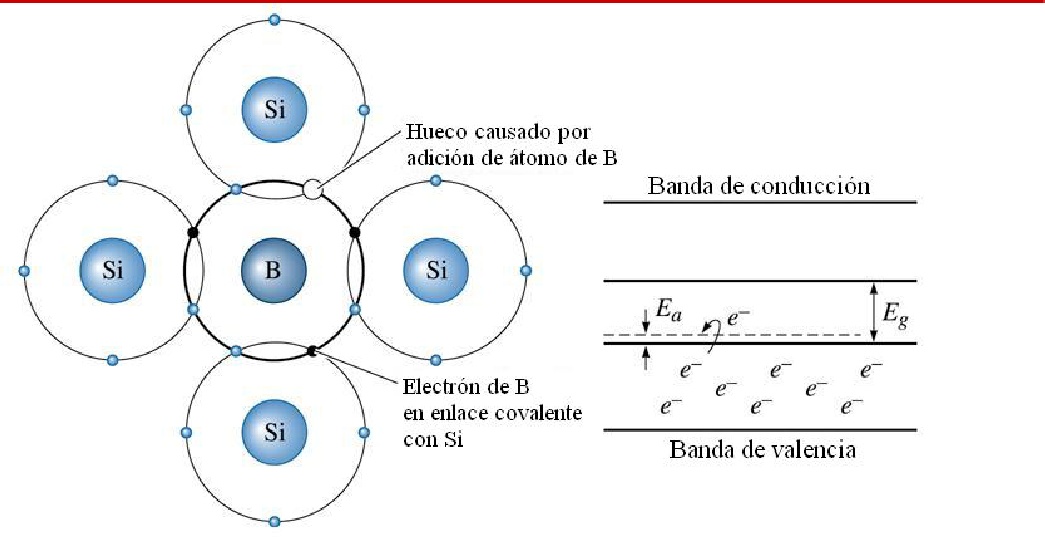
BIBLIOGRAFIA:
es.wikipedia.org/wiki/Semiconductor
www.kalipedia.com/tecnologia/tema/electronica/teoria-bandas....
www.arqhys.com/construccion/semiconductores-propiedades.html
http://es.wikipedia.org/wiki/Dopaje_(semiconductores)
http://es.scribd.com/doc/49705458/semiconductores
http://usuarios.multimania.es/docentesing/tbd/Capitulo3y4.pdf
Trabajo realizado por Cecilia Hernández y Rubén Alonso 2ºBC Bachillerato


 El
El