Superconductores
Definición. Características a 0 K. Materiales.


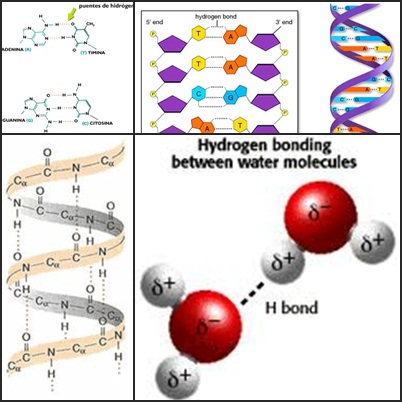
Los superconductores son un tipo especial de materiales que pueden conducir la corriente eléctrica casi sin ofrecer resistencia, y, por tanto, sin que se produzca una “pérdida” energética. Es decir, los metales son buenos conductores, tanto térmicos como eléctricos, pero estos se calientan al conducir un flujo de electrones, porque los átomos del metal vibran y chocan contra estos. Ofrecen resistencia y se pierde energía en forma de calor. Esto no es rentable en algunas ocasiones.
Hay varias teorías, modelos que ayudan a comprender mejor este fenómeno, pero son de gran complejidad.
Al disminuirla temperatura, también lo hace la resistencia del metal a la corriente eléctrica, por lo que, a temperaturas en torno al 0 K, algunos materiales se convierten en superconductores. Pueden ser diversos metales, si se enfrían lo suficiente (algunas aleaciones, o, incluso, compuestos de carbono).
Los materiales se suelen enfriar con helio líquido, lo que es bastante costoso. Por tanto, se está investigando con superconductores de “alta temperatura”, que superconducen a temperaturas tan “elevadas” como 77 K, pudiendo ser enfriados con nitrógeno líquido, mucho más barato.
Clasificación
Los superconductores, se pueden clasificar atendiendo a varios aspectos, como los materiales que los componen (puros o aleaciones, estructuras de carbono); la temperatura a la que son superconductores (temperatura crítica), en superconductores de alta o baja temperatura. La clasificación más utilizada es según su comportamiento físico.
Se distinguen dos tipos de superconductores:
- Superconductores de tipo I, que impiden que los campos magnéticos penetren en ellos, es decir, los apantallan (efecto Meissner). Son elementos puros con una temperatura crítica muy baja.
- Superconductores de tipo II, son supercondiuctores "imperfectos" que permiten que que los campos magnéticos penetren en su interior, pasando gradualmente del estado superconductor al normal. Entre ellos se encuentran aleaciones, sustancias cerámicas.
APLICACIONES:
Las aplicaciones de los superconductores son muy diversas, y, como estos materiales aún están siendo investigados, cada vez se van ampliando sus utilidades. Las líneas de investigación se centran en cómo conseguir disminuir la resistencia de los metales al paso de la corriente eléctrica, a la temperatura más elevada posible, para rentabilizar su obtención
Por tanto, se está tratando de encontrar nuevos materiales.
Las principales aplicaciones se encuentran relacionadas con sus propiedades magnéticas, siendo utilizados en campos tan dispares como el transporte o la medicina. Al ser enfriados y sometidos a un campo magnético,pueden llegar a levitar. Así, se trata de emplear en trenes de alta velocidad, en países como Japón, pues esta levitación evita el roce con las vías y permite un aumento de velocidad (¡¡¡hasta 550km/h!!!). Este es el caso del tren Maglev de Shangai.
Se utilizan en medicina, para las resonancias magnéticas nucleares.
También, en Sistemas de Transporte de energía. Al ser casi nula la resistencia que ejercen, permitirían transportan electricidad a grandes distancias sin que ésta se disipe en el entorno en forma de calor.
Incluso se está tratando de trabajar con ellos para el almacenamiento de energía. Además pueden ser utilizados en medicina, para resonancias magnéticas nucleares, o en el estudio de moléculas (espectroscopia de resonancia magnética nuclear).
Como ocurre casi con todo en la ciencia actual, se trata de un mundo prometedor que está en expansión y que casi acaba de comenzar, por lo que sus aplicaciones podrían llegar hasta límites casi insospechados, si la investigación es la adecuada.
Además, llegan a ser utilizados en aceleradores de partículas.


( Acelerador de partículas)
Bibliografía.
Para la elaboración de este trabajo han sido consultad@s: