Ciclo de Born-Haber para el CaO.
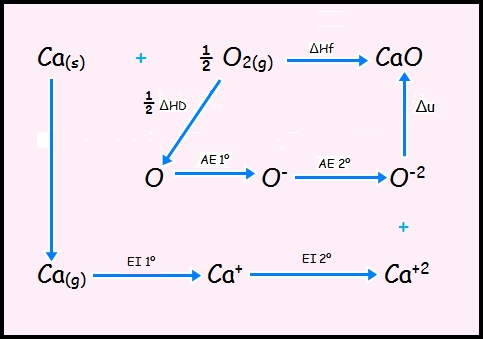
La energía reticular o energía de red es la energía requerida para separar completamente un mol de un compuesto iónico en sus iones gaseosos. Muestra la estabilidad de la red cristalina. La energía reticular presenta dimensiones de energía/mol y las mismas unidades que la entalpía estándar (ΔHo), pero de signo contrario, es decir kJ /mol.
No es posible medir la energía reticular directamente por lo que se recurre a métodos indirectos aplicando la ley de Hess. Es lo que se conoce como ciclo de Born y Haber.
Factores de los que depende:
Al ser siempre negativa consideraremos siempre valores absolutos.
A mayor carga de los iones mayor U.
Ejemplo: Así el CaO (Ca+2 y O-2) tendrá U mayor que el NaCl (Na+ y Cl-).
A menor tamaño de los iones menor U.
Ejemplo: Así el NaCl (Na+ y Cl) tendrá U mayor que el KBr (K+ y Br).
Energías que intervienen:
Camino directo. El calcio solido Ca(s) y el O2(g) se unen para formar un mol de cristal iónico solido. En el proceso se desprende el calor de formación o entalpia molar de formación (∆Hf) del CaO.
Camino indirecto. Vaporización de un mol de Ca(s): se absorbe la energía molar de sublimación (∆Hs) del Ca.
Disociación (∆HD) del de ½ mol de O2(g): Se absorbe la mitad de la energía molar de enlace.
Ionización (EI 1ª y EI 2ª) de un mol de átomos de Ca: Se absorbe la energía molar de ionización del Ca. El calcio debido a la energía de ionización 1ª pasa a Ca+ y con la 2ª energía de ionización pasa de Ca+ a Ca+2
Ionización de un mol de átomos de O(g): Se desprende la afinidad electrónica (AE 1º) molar del oxigeno para transformarlo en 0- y aplicando la (AE 2º) se transforma en O-2
Condensación de los iones gaseosos para formar un mol de solido: Se desprende la energía de red (u) del CaO.
FORMULA: ∆Hf= EI1º+EI2º+1/2 ∆HD+AE1º+AE2º+∆u
BIBLIOGRAFIA: Libro de 2ª de Bachillerato de química de Edebé.
resno.pntic.mec.es/~fgutie6/quimica2/.../08EnlaceQuímico.pp
0 comentarios