Geometría de la molécula de HNO2
ESTRUCTURA DE LEWIS.
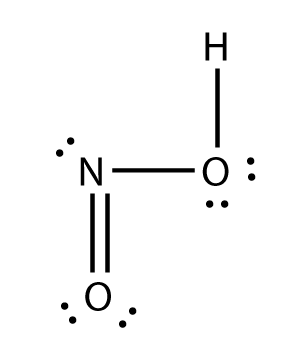
electrones totales= 18
electrones enlazados= 8
electrones sin enlazar= 10
TEORÍA DE REPULSIÓN DE LOS PARES DE ELECTRONES DE LA CAPA DE VALENCIA.
Según la TREPCV la estructura más estable es la que nos da las menores repulsiones entre los pares de electrones enlazados y los pares de electrones sin enlazar. De este modo la geometría de esta molécula será angular, con un ángulo de 119,5º puesto que proviene de una distribución electrónica trigonal plana ya que el átomo central (nitrógeno) distribuye sus electrones hacia tres direcciones en el espacio.
MODELO DE HIBRIDACIÓN.
Para estudiar su hibridación deberemos realizar primero su configuración eléctronica:
7N: 1s2 2s2 2p3 — hibridación → 1s2 + 3 orbitales híbridos sp2 + ppuro
Tras estudiar la configuración, llegaremos a la conclusión de que se produce una hibridación de los orbitales, produciendose 3 orbitales sp2.
Finalmente, el modelo hibridado de la molécula será el siguiente:

JUSTIFICACIÓN DE SU POLARIDAD Y GEOMETRÍA.
El momento dipolar del enlace es distinto de 0, ya que los átomos entre los que se establece el enlace no son iguales, por tanto el enlace es polar.
µ molecular = suma µ enlaces, que es distinta de 0, por tanto la molécula es polar.
Pedro José Baños, María José Vigueras y Sergio Monpeán
Alumnos de 2ºA Bachillerato
0 comentarios