Ciclo de Born-Haber del AlF3
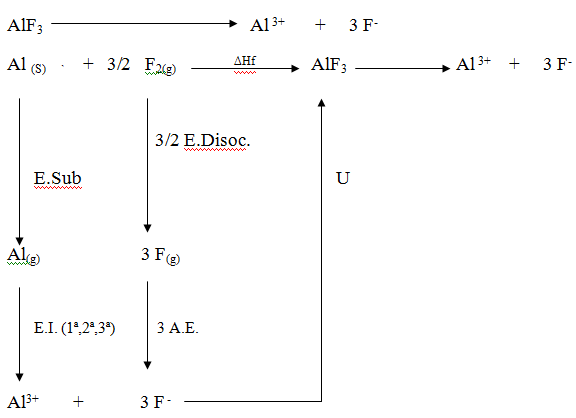
Energía reticular (U): es la energía requerida para separar completamente un mol de un compuesto iónico en sus iones gaseosos, muestra la estabilidad de la red cristalina .La energía reticular presenta dimensiones de energía/mol y las mismas unidades que la entalpía estándar.
Energías que intervienen:
Camino directo. El aluminio solido Al(s) y el fluor F(g) se unen para formar un mol de cristal iónico sólido. En el proceso se desprende el calor de formación o entalpia molar de formación (∆Hf) del AlF3.
Camino indirecto. Vaporización de un mol de Al(s): se absorbe la energía molar de sublimación (∆Hs) del Al.
Ionización (EI 1ª, EI 2ª y EI 3ª) de un mol de átomos de AL: Se absorbe la energía molar de ionización del Al. El aluminio debido a la energía de ionización 1ª pasa a Al+ , con la 2ª energía de ionización pasa de Al+ a Al+2 y con la 3ª pasa de Al2+ a Al3+
Disociación. Se separan las moléculas de F2 dando lugar a 2 F.
Se desprende la afinidad electrónica (AE 1º) molar del fluor para transformarlo en F-
Condensación de los iones gaseosos para formar un mol de solido: Se desprende la energía de red (u) del AlF3.
FORMULA: ∆Hf= ES+1ª(EI)+2ª(EI)+3ª(EI)+3/2 ED+AE+AE+∆U
0 comentarios