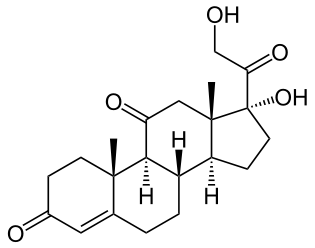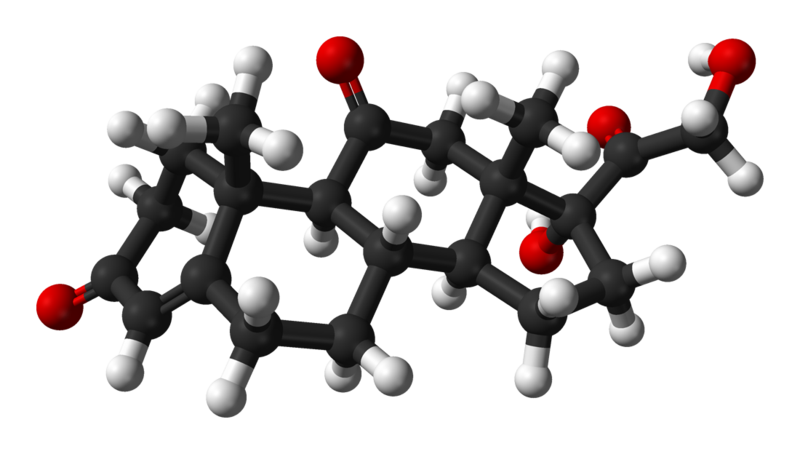
El colesterol
Fórmula condensada o molecular: C27H46O
Nombre propio/Sistemático: Colesterol/(10R,13R)-10,13-dimetil-17-(6-methilheptan-2-il)-2,3,4,7,8,9,11,12,14,15,16,17-dodecahidro-1H-ciclopenta[a]pentantrien-3-ol
Características físicas:
- Peso molecular: 386,66 u (umas)
- Olor: prácticamente inoloro.
- Solubilidad: insoluble en agua y bien soluble en sustancias orgánicas como el cloroformo o formol como todos los lípidos.
- pH neutro
- Punto de ebullición y fusión: 421,15 K (148 °C) y 633,15 K (360 °C)
- Densidad de vapor igual al aire (1)
- Estable y baja posibilidad de reactividad.
- Peligroso en descomposición puede formar CO2 y CO en descomposición por calentamiento.
- No tiene capacidad de polimerización. Incompatible con oxidantes fuertes.
10. Apariencia física: polvo blanco cristalino.
Caracterísicas químicas:
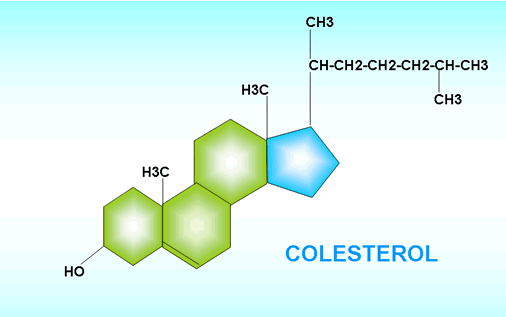
Es un lípido esteroide, molécula de ciclopentanoperhidrofenantreno (o esterano), constituida por cuatro carboxiclos condensados o fundidos, denominados A, B, C y D, que presentan varias sustituciones:
- Dos metilo en los carbonos 10 y 13
- Cadena alifática ramificada de 8 carbonos en el carbono 17
- Grupo hidróxido en el carbono 3 (-ol)
- Dos insaturaciones entre los carbonos 5 y 6.
Uso e importancia del colesterol:
El colesterol es una sustancia orgánica perteneciente al macrocomplejo de los lípidos, perteneciendo al grupo de lípidos no saponificables (grasas o acilglicéridos que no forman jabones), más concretamente a los esteroides.
Es una molécula de gran interés biológico e indispensable para la célula animal, ya que al no tener una pared celular estable y fuerte necesita una molécula especial que permita que sus capas de lípidos (ácidos grasos) de su membrana consigan estabilidad y no se “despeguen” y no pierdan sus propiedades. Por tanto, es una molécula indispensable para la vida ya que es necesaria para el crecimiento y desarrollo de todas las células.
Se encuentra en todos los órganos del cuerpo, siendo muy común en la piel, hígado y plasma sanguíneo.
El colesterol es el principal compuesto del grupo de esteroides, ya que de él provienen la mayoría de esteroides, como la vitamina D (imprescindible para la sodificación de calcio y fósforo en huesos) que se fabrica con rayos solares sobre la piel, las hormonas sexuales (progresterona, estrógenos y testosterona),otras hormonas corticoides como el cortisol (antiinflamatorio) y aldosterona(presión arterial) y las sales biliares para emulsión de grasas en la digestión (romper mejor las grasas y así coger sus nutrientes mejor).
El colesterol al ser muy insoluble en agua en la sangre (medio acuoso) como muchos lípidos es unido a un grupo especial de transporte llamado lipoprotreínas para su transporte al organismo:
- Lipoproteínas de baja densidad (Low density lipoproteins o LDL en inglés): conocido erróneamente como “colesterol malo” por dos razones: no es el colesterol en sí el “malo” si no la proteína, ya que al tener menos densidad lleva menos colesterol en menos volumen y dos, ese es el colesterol que se transporta desde el hígado hasta el resto del organismo para la reparación y reconstrucción de tejidos celulares, dando su importancia vital. Esta lipoproteína se encuentra solo en tejidos animales (nunca en vegetales como trigo, pan, aceites de oliva, arroz, etc…) y el organismo de por sí la sabe fabricar, el verdadero problema es el consumido en la dieta, ya que tiene mayor capacidad de oxidación y bloquea los capilares sanguíneos cuando hay un exceso y la célula no puede absorber más de lo que necesita.
- Lipoproteínas de alta densidad (High density lipoprotein, HDL o “colesterol bueno”): también así conocido erróneamente ya que es la proteína y no el colestero, que es el mismo, como esta proteína es más grande, puede engancharse a ella mayor número de moléculas de colesterol y otros triglicéridos para su destrucción desde tejidos del organisma hasta el hígado, permitiendo así arrastrar a más LDL y limpiar capilares.