Formación de la Lluvia Ácida
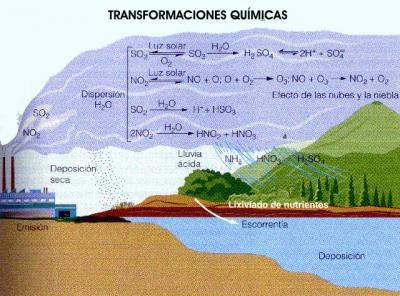
La lluvia ácida se forma cuando la humedad en el aire se combina con el óxido de nitrógeno y el dióxido de azufre emitidos por fábricas, centrales eléctricas y vehículos que queman carbón o productos derivados del petróleo. En interacción con el vapor de agua, estos gases forman ácido sulfúrico y ácidos nítricos. Finalmente, estas sustancias químicas caen a la tierra acompañando a las precipitaciones, constituyendo la lluvia ácida.
La lluvia normalmente presenta un pH de aproximadamente 5.6 (ligeramente ácido) debido a la presencia del CO2 atmosférico, que forma ácido carbónico, H2CO3. Se considera lluvia ácida si presenta un pH de menos de 5 y puede alcanzar el pH del vinagre (pH 3). Estos valores de pH se alcanzan por la presencia de ácidos como el ácido sulfúrico, H2SO4, y el ácido nítrico, HNO3. Estos ácidos se forman a partir del dióxido de azufre, SO2, y el monóxido de nitrógeno que se convierten en ácidos.
Una gran parte del SO2 (dióxido de azufre) emitido a la atmósfera procede de la emisión natural que se produce por las erupciones volcánicas, que son fenómenos irregulares. Sin embargo, una de las fuentes de SO2 es la industria metalúrgica.
El SO2 puede proceder también de otras fuentes, por ejemplo como el sulfuro de dimetilo, (CH3)2S, y otros derivados, o como sulfuro de hidrógeno, H2S. Estos compuestos se oxidan con el oxígeno atmosférico dando SO2.
Finalmente el SO2 se oxida a SO3 (interviniendo en la reacción radicales hidroxilo y oxígeno) y este SO3 se puede quedar disuelto en las gotas de lluvia, es el de las emisiones de SO2 en procesos de obtención de energía: el carbón, el petróleo y otros combustibles fósiles contienen azufre en unas cantidades variables (generalmente más del 1%), y, debido a la combustión, el azufre se oxida a dióxidos de azufre:
S + O2 → SO2Hay otros procesos industriales en los que también se genera SO2, por ejemplo en la industria metalúrgica. Este SO3 se puede quedar disuelto en las gotas de lluvia, en forma de H2SO4. La reacción global es:
SO2 + OH· + O2 + nH2O → HOO· + H2SO4(ac)También se puede depositar sobre superficies húmedas.
El NO se forma por reacción entre el oxígeno y el nitrógeno a alta temperatura:
O2 + N2 → 2NOUna de las fuentes más importantes es a partir de las reacciones producidas en los vehículos de los automóviles y aviones. Este NO se oxida con el oxígeno atmosférico:
O2 + 2NO → 2NO2Y este 2NO2 reacciona con el agua dando ácido nítrico que se disuelve en el agua:
3NO2 + H2O → 2HNO3 + NO
EFECTOS DE LA LLUVA ÁCIDA
Son conocidos los efectos de esta lluvia ácida sobre las tierras de cultivo, los bosques y la fauna de ríos y lagos. Ahora, destacamos además, el enorme deterioro que produce sobre los monumentos y construcciones de piedra caliza y mármol, dónde el CaCO3, es disuelto progresivamente mediante reacciones como estas:
CaCO3 (s) + H2SO4 (aq) → CaSO4 (s) + H2O(l) + CO2(g)
2CaCO3 (s) + 2SO2 (g) + O2(g)→ 2CaSO4 (s) +2CO2(g)
El CaSO4 producido es lo suficientemente soluble para ser, poco a poco, disuelto y arrastrado por el agua.
Algunos monumentos y construcciones han sido protegidos de este deterioro recubriéndolos de ciertas sustancias cuya reacción produce BaCO3. Éste es tan insoluble como CaCO3, pero cuando este es atacado por el H2SO4 de la lluvia ácida forma CaSO4, un compuesto aún más insoluble que el CaCO3.