Entropía
La entropía está relacionada con el segundo principio de la termodinámica, que dice: "la entropía del universo aumenta en un proceso irreversible y se mantiene constante en los reversibles”.
Debido a esta ley, conocemos que el flujo espontáneo de calor siempre es unidireccional, desde los cuerpos de mayor temperatura hacia los de menor temperatura, hasta lograr un equilibrio térmico.
La aplicación más conocida es la de las máquinas térmicas, que obtienen trabajo mecánico mediante aporte de calor de una fuente o foco caliente, para ceder parte de este calor a la fuente o foco o sumidero frío. La diferencia entre los dos calores tiene su equivalente en el trabajo mecánico obtenido.

- Pérdidas energéticas:
Podemos decir, que la entropía equivale a "desorden"; así, encontramos que en el trayecto hacia el equilibrio, punto en el que el sistema ha perdido su energía libre (en un péndulo al que hemos comunicado un movimiento: oscilará cada vez menos hasta que ese movimiento cese. En ese momento habrá alcanzado el equilibrio)el sistema cede energía que puede acabar transformándose en trabajo, pero no TODA la energía libre se transforma en trabajo, una parte se pierde, esa pérdida energética (a menudo en forma de calor) acaba generando entropía. En cierto sentido podemos definir la entropía como el resultado de las “perdidas” energéticas del sistema. Son las parte de energía libre no aprovechable, la cual se acumula en el equilibrio al final del proceso y hace que aumente el desorden.

Ejemplos de pérdidas energéticas:
- - Los motores tienen pérdidas de eficiencia energética al generar calor
- -Las estrellas transforman sus fuentes energéticas hasta llegar a un equilibrio en el que toda su energía ha sido cedida al Universo y su materia se esparce caóticamente por el espacio aumentando su entropía.
- -Los seres vivos ,para ganar en organización, "expulsan" entropía al medio para avanzar hacia el equilibrio termodinámico
- Móvil perpetuo:
Desde hace cientos de años las personas han intentado construir máquinas que funcionen eternamente tras un impulso inicial sin administrar después más energía. Esta máquina se denomina móvil perpetuo y hay de varias especies. Un móvil perpetuo de segunda especie es una máquina hipotética capaz de extraer toda la energía térmica acumulada en cualquier cuerpo u objeto y convertirla en la misma cantidad de energía mecánica o trabajo útil de forma cíclica.
Este tipo de móvil perpetuo provoca la aparición de la Segunda ley de la termodinámica: Es imposible construir una máquina que absorba cíclicamente el calor de un foco calorífico y lo convierta íntegramente en trabajo. Esto implica que la cantidad de energía que no ha podido ser transformada en trabajo se cede en forma de calor a otro foco térmico, pudiendo ser éste el aire que rodea al primer foco de calor. Así, hay que estimar que siempre se producen “pérdidas energéticas” en forma de calor.
http://www.youtube.com/watch?v=nsZPmL-M2gg&feature=related
- Bibliografia:
- Libro de segundo de bachillerato de quimica, Editorial: Edebé
- Libro de segundo de bachillerato de química, Editorial:Bruño
- http://es.wikipedia.org/wiki/Termodin%C3%A1mica#Segunda_ley_de_la_termodin.C3.A1mica
- http://acer.forestales.upm.es/basicas/udfisica/asignaturas/fisica/termo2p/maquinas.html
- http://www.loreto.unican.es/Termodin/TermoMovPer.pdf
- http://es.wikipedia.or g/wiki/M%C3%B3vil_perpetuo


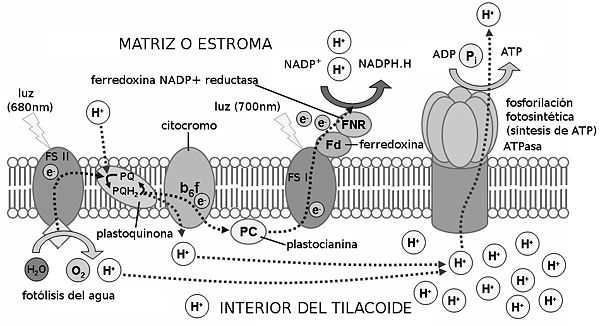
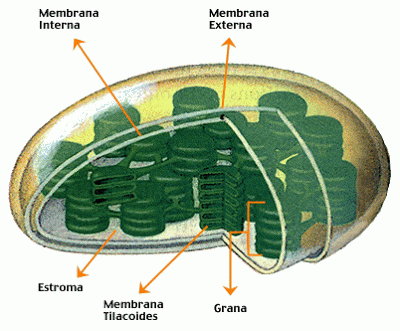 Esquema de un cloroplasto
Esquema de un cloroplasto