CERO ABSOLUTO DE TEMPERATURA
DEFINICIÓN
El cero absoluto es la temperatura teórica más baja posible. A esta temperatura el nivel de energía del sistema es el más bajo posible, por lo que las partículas, según la mecánica clásica, carecen de movimiento; no obstante, según la mecánica cuántica, el cero absoluto debe tener una energía residual, llamada energía de punto cero, para poder así cumplir el principio de indeterminación de Heisenberg. El cero absoluto sirve de punto de partida tanto para la escala de Kelvin.
Así, 0 K corresponden, aproximadamente, a la temperatura de −273,15 ºC
ESTUDIO MICROSCÓPICO DE LA MATERIA
Las primeras incursiones en estas esferas límites de la materia tuvieron relación con la experimentación de gases cuya sensibilidad a la temperatura y la presión los convierte en cuerpos ideales para profundizar en los extremos térmicos de la materia.
Tomando como base la ecuación descrita por Boile, Charles y Lussac, donde temperatura, presión y volumen se afectan mutuamente, la presión sería nula siempre que existiera una temperatura cero.
Cuando la materia se enfría, las partículas que la componen, van perdiendo energía progresivamente. En teoría, cuando se llega al cero absoluto, es tal la falta de energía que sufre el sistema que a nivel subatómico, los electrones empiezan a "caer" en órbitas cada vez más cercanas al núcleo.
Se ha llegado a descender hasta 0,7 K, temperaturas criogénica, mediante técnicas muy sofisticadas donde se usa helio líquido. El helio alcanza su punto de ebullición a -268,9 ºC y puede manipularse en criostatos: recipientes extremadamente aislados diseñados por un ingeniero mecánico norteamericano: Samuel Collins.
Se supone que, al llegar al extremo de las bajas temperaturas, los electrones que pululan alrededor del núcleo atómico caigan finalmente en espiral sobre ese centro másico atraídos por la vieja fuerza gravitatoria.
Sin embargo este comportamiento estaría contradiciendo un principio fundamental de la física moderna: El Principio de Incertidumbre postulado por Werner Heisenberg. En efecto, este bastión de la física cuántica afirma que en ningún caso podremos conocer, sin un margen de error determinado, la velocidad (c) y la posición (p) exactas de la partícula.
Pero si sabemos que en el cero absoluto los electrones caerán sobre al núcleo debido a su pérdida energética, en franca discrepancia con el principio citado anteriormente, estaríamos conociendo su velocidad ( c = 0) y su posición ( p = núcleo del átomo)
Tal vez estas conclusiones no sean, después de todo, tan contradictorias. Quizá, cuando los electrones hayan colapsado, ya no sean electrones, ni partículas de ninguna clase, tal vez se trate ahora de un aglutinado núcleo sin periferia, una forma de materia sin propiedades electrónicas.
http://upload.wikimedia.org/wikipedia/commons/a/af/Bose_Einstein_condensate.png
En física, el condensado de Bose-Einstein es el estado de agregación de la materia que se da en ciertos materiales a muy bajas temperaturas. La propiedad que lo caracteriza es que una cantidad macroscópica de las partículas del material pasan al nivel de mínima energía, denominado estado fundamental.
TERCERA LEY DE TERMODINÁMICA
El tercer principio de la termodinámica o tercera ley de la termodinámica afirma que no se puede alcanzar el cero abosoluto en un número finito de etapas. Sucintamente, puede definirse como:
- Al llegar al cero absoluto, 0 K, cualquier proceso de un sistema físico se detiene.
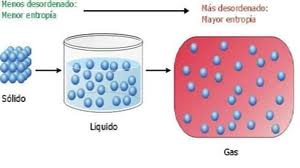
- Al llegar al cero absoluto la entropía alcanza un valor mínimo y constante.
En términos simples, la tercera ley indica que la entropía de una sustancia pura y cristalina en el cero absoluto es nula. Por consiguiente, la tercera ley provee de un punto de referencia absoluto para la determinación de la entropía. La entropía relativa a este punto es la entropía absoluta.
BIBLIOGRAFIA: WIKIPEDIA, Soloexactas.com.ar