Síntesis industrial del amoniaco
PROCESO INDUSTRIAL
El amoníaco, NH3, es un gas incoloro, de característico olor sofocante y muy soluble en agua. Es de gran utilidad como materia prima para la obtención de fertilizantes amoniacales, fibras sintéticas, materiales plásticos, tintes, pegamentos, explosivos, productos farmacéuticos, ácido nítrico, etc.
La calidad que  se comercializa en la actualidad es de gran pureza, debiendoestarexento de metanol y otros compuestos oxigenados. Puede estar contaminado con aceites procedentes del engrase de los compresores. Para evitar la presencia de metanol en el producto final el gas de síntesis debe ser depurado eliminando los restos de CO y CO2 que hayan podido escapar de la conversión y de la descarbonatación del gas de síntesis. La depuración más convencional se realiza mediante las reacciones de metanización de ambos óxidos de carbono, que son inversas de las de reformado con vapor:
se comercializa en la actualidad es de gran pureza, debiendoestarexento de metanol y otros compuestos oxigenados. Puede estar contaminado con aceites procedentes del engrase de los compresores. Para evitar la presencia de metanol en el producto final el gas de síntesis debe ser depurado eliminando los restos de CO y CO2 que hayan podido escapar de la conversión y de la descarbonatación del gas de síntesis. La depuración más convencional se realiza mediante las reacciones de metanización de ambos óxidos de carbono, que son inversas de las de reformado con vapor:
CO + 3 H2 <----> CH4 + H2O
CO2 + 4 H2 <----> CH4 + 2 H2O
El metano producido no afecta a la pureza del amoníaco, aunque perjudica al equilibrio y debe ser purgado del circuito de síntesis, como sucede con el argón que acompaña al aire que se introduce en el reformador secundario.
En su conjunto, las plantas modernas de fabricación de amoníaco constan de seis unidades interconectadas: el reformado con vapor, con sus dos reformadores (primario y secundario), el enfriamiento y conversión del gas reformado, la descarbonatación con carbonato potásico y/o monometilamina (MEA) y finalmente el bucle de síntesis.
Para la obtención del amoníaco por síntesis catalítica de nitrógeno e hidrógeno se introdujo a principios del siglo XX el proceso Haber. Ésta reacción de síntesis tiene lugar mediante el equilibrio:
N2(g) + 3H2(g) <----> 2 NH3 (g) ; ΔH º= -92.6 kJ
El nitrógeno se obtiene del aire atmosférico, donde representa alrededor del 80%, mientras que el hidrógeno se produce por reacción del agua con carbón a alta temperatura o como resultado de ciertos procesos de refino del petróleo.
El proceso Haber es de gran importancia, ya que transforma el nitrógeno atmosférico en amoníaco, lo que lo convierte en materia prima para numerosos productos de gran utilidad en nuestra sociedad.
La evolución de la síntesis del amoniaco ha estado impulsada por la necesidad de plantas de mayor capacidad de producción, con dificultades para refrigerar los reactores y mantener las temperaturas por debajo de las que resisten los aceros al carbono. Por ello se ha ido reduciendo progresivamente la presión de operación y, en consecuencia, la conversión por paso.
ESTUDIO ENERGÉTICO, RENDIMIENTO Y CONDICIONES ÓPTIMAS
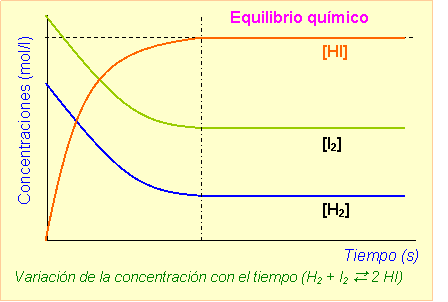
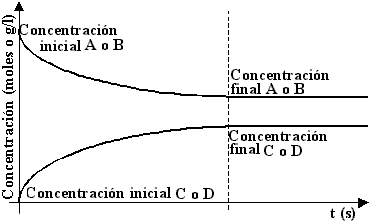
El amoníaco se sintetiza en una reacción en la que existe un equilibrio. Según el principio de Le Chatelier, las condiciones óptimas se alcanzan elevando la presión total cuando hay una reducción de moles (de 4 a 2 en este caso) y a baja temperatura, ya que así se consigue desplazar el citado equilibrio hacia la derecha, favoreciendo la formación del NH3.
En cuanto al rendimiento, no existe un valor exacto. Para aumentarlo, debemos alejarlo de las condiciones teóricas ideales. Los gases que lo forman deben comprimirse entre 200 y 1000 atmósferas, calentándose unos 450 oC en un recipiente de reacción. En ella, interviene un catalizador, principalmente formado por hierro.
Una vez formado el NH3, se enfría el recipiente para licuar el amoniaco, separándose de la mezcla de N2 y H2 que no han reaccionado y favoreciendo el desplazamiento del sistema hacia la producción de NH3.
BIBLIOGRAFÍA
Libro de química de 2º de Bachillerato, Edebé
http://www.diquima.upm.es/docencia/tqindustrial/docs/cap3_amoniaco.pdf
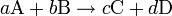
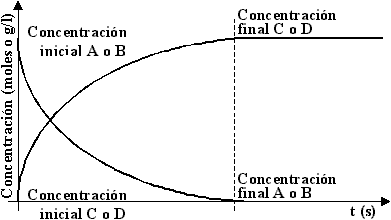
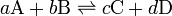
 )
) 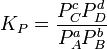
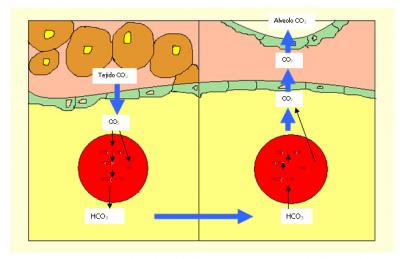 En todo momento, nuestro cuerpo está consumiendo oxígeno a razón de unos 240 ml por minuto en actividad normal. Las distintas partes del organismo necesitan el O2 para, por reacción con los hidratos de carbono, producir energía. Es la sangre quien se encarga de transportarlo de los pulmones a las células, y, como sabemos, es este proceso se libera CO2.
En todo momento, nuestro cuerpo está consumiendo oxígeno a razón de unos 240 ml por minuto en actividad normal. Las distintas partes del organismo necesitan el O2 para, por reacción con los hidratos de carbono, producir energía. Es la sangre quien se encarga de transportarlo de los pulmones a las células, y, como sabemos, es este proceso se libera CO2.