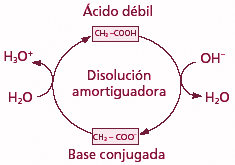
Tampón fosfato
Es decir, a pH fisiológico, las especies del fosfato con capacidad de tamponar son H2PO4- y HPO4-2 ya que su valor de pK es de 6,8.
Así pues, para el tampón fosfato:
pH = 6,8 + log HPO4-2 / H2PO4-A pH fisiológico de 7,4 la concentración de HPO4-2 (un 80%) es 4 veces superior a la de H2PO4- (un 20%). Así pues, el tampón fosfato es un sistema muy eficaz para amortiguar ácidos.
La concentración de fosfato en la sangre es baja (2 mEq/L) por lo que tiene escasa capacidad de tamponar si lo comparamos con otros tampones como el bicarbonato. En cambio, a nivel intracelular, las concentraciones de fosfato son elevadas lo que le convierte en un tampón eficiente. Las grandes cantidades de fosfato dentro de las células corporales y en el hueso hacen que el fosfato sea un depósito grande y eficaz para amortiguar el pH.