Cristal/ Vidrio
El Vidrio
El vidrio es un material inorgánico que se encuentra en la naturaleza a partir de materiales volcánicos, las tectitas o la obsidiana, aunque también puede ser fabricado por el hombre. Se caracteriza por ser duro, frágil y transparente (también puede ser manipulado para resultar opaco o traslúcido). En relación a sus usos, el vidrio artificial se utiliza para hacer ventanas, lentes, y botellas, así como una gran variedad de productos. El vidrio es un tipo de material cerámico amorfo que se obtiene por fusión a unos 1.500 °C de arena de sílice (SiO2), carbonato de sodio (Na2CO3) y caliza (CaCO3).
Con respecto al origen etimológico del término, no se ha determinado aún con certeza la prodecencia del mismo.A raíz de diversos textos, como Historia Natural de Plinio el Viejo, escrita en el primer siglo después de Cristo, se ofrecen buenas evidencias acerca de la región geográfica en la que pudo haber sido descubierto el vidrio y sobre la manera accidental en que tal episodio ocurrió. No obstante, los detalles del descubrimiento narrado son poco fiables, ya que las temperaturas que se requieren para fundir el vidrio no coinciden con las expuestas en la obra.

El Cristal
El cristal es un sólido homogéneo que presenta una estructura interna ordenada de sus partículas reticulares, sean átomos, iones o moléculas. La mayoría de los cristales naturales se forman a partir de la cristalización de gases a presión en la pared interior de cavidades rocosas llamadas geodas. La calidad, tamaño, color y forma de los cristales dependen de la presión y composición de gases en dichas geodas (burbujas) y de la temperatura y otras condiciones del magma donde se formen. La palabra proviene del griego crystallos, nombre que dieron los griegos a una variedad del cuarzo, que hoy se llama cristal de roca.
La principal diferencia es que: el cristal es homogéneo, posee una estructura molecular simétrica y ordenada, mientras que el vidrio no.

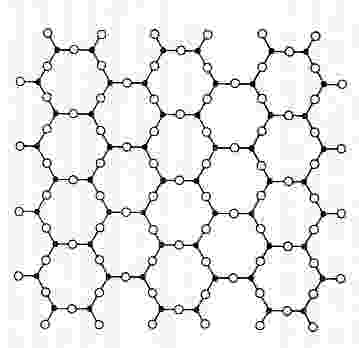
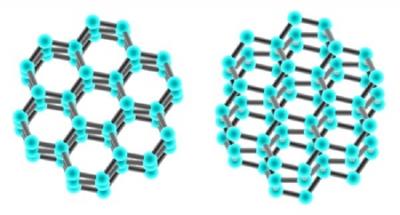
Cristal organizado de SiO2
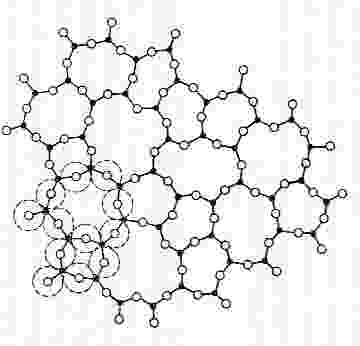
SiO2 en su forma cristalina
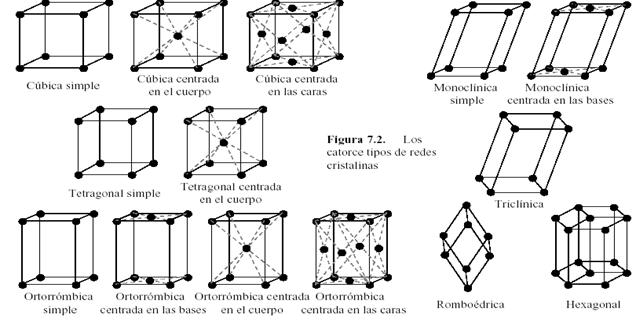
Redes Cristalinas
La red cristalina está formada por iones de signo opuesto, de manera que cada uno crea a su alrededor un campo eléctrico que posibilita que estén rodeados de iones contrarios.
Los sólidos cristalinos mantienen sus iones prácticamente en contacto mutuo, lo que explica que sean prácticamente incompresibles. Además, estos iones no pueden moverse libremente, sino que se hallan dispuestos en posiciones fijas distribuidas desordenadamente en el espacio formando retículos cristalinos o redes espaciales. Los cristalógrafos clasifican los retículos cristalinos en siete tipos de poliedros llamados sistemas cristalográficos. En cada uno de ellos los iones pueden ocupar los vértices, los centros de las caras o el centro del cuerpo de dichos poliedros. El más sencillo de éstos recibe el nombre de celdilla unidad.