Definición
Una bomba de calor es una máquina térmica capaz de transferir calor de un ambiente a otro, es decir, desde una fuente fría a otra más caliente. Del mismo modo, una bomba de frío es una máquina térmica capaz de transferir frío de una fuente caliente a otra que está a menor temperatura.
Leyes de la Termodinámica
Las leyes de la termodinámica son fundamentalmente dos, aunque previas a éstas existe un llamado “principio cero de la termodinámica”. Dicho principio nos proporciona una definición precisa de la temperatura y enuncia que “Si dos sistemas distintos (A y B) están en equilibrio termodinámico con un tercero (C), también tienen que estar en equilibrio entre sí. La propiedad compartida en el equilibrio es la temperatura.
La primera ley de la termodinámica enuncia que “La energía ni se crea ni se destruye, por lo que, en cualquier proceso termodinámico, la cantidad total de energía del universo se mantiene constante”
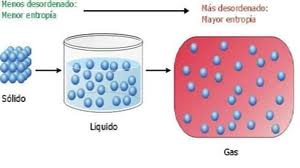
La segunda ley de la termodinámica establece que “en cualquier sistema aislado, el grado de desorden tiende siempre a aumentar”, o lo que es lo mismo, que la entropía del universo aumenta de manera constante respecto al tiempo.
Aplicaciones
La bomba de frío/calor se emplea fundamentalmente en sistemas de climatización y sistemas de aire acondicionado domésticos. Existen diferentes tipos, el más común es la bomba de calor aire-aire instalado en viviendas y que capta el frío o calor del exterior y lo transfiere al interior de la vivienda a mayor o menor temperatura según decida el usuario. La bomba de calor también permite en algunos casos la llegada de agua caliente doméstica a la vivienda.
También se emplean en el sector terciario y en la industria con el objetivo principal de recuperar el calor que se produce en estas instalaciones y que de otro modo sería disipado sin aprovechamiento alguno. Posteriormente este calor se puede emplear para calefacción-refrigeración, para el calentamiento de agua o para el secado de productos.
Funcionamiento sencillo
Las bombas de frío-calor constan de 4 elementos: evaporador, compresor, condensador y válvula de calor. Su funcionamiento es el siguiente:
- Se aspira aire del ambiente que pasa a través de un evaporador, donde hay un fluido refrigerante, el cual se encuentra a baja temperatura y baja presión, es decir, en estado líquido. Al pasar por el evaporador, el fluido refrigerante absorbe la temperatura del aire ambiente y cambia de estado, pasando a ser gaseoso. Al mismo tiempo, este aire es expulsado a una temperatura más baja.
- El fluido refrigerante llega a un compresor en forma de vapor, pero al pasar a través de este se produce un aumento de la presión con el consiguiente aumento de temperatura y entalpía.
- Se obtiene vapor en un estado elevado de energía. Este vapor circula a través un condensador, y, al estar más caliente que éste, va cediendole todo el calor acumulado , volviendo así a estado líquido.
- En el último paso, el fluido refrigerante de nuevo en estado líquido, pasa por una válvula de expansión para obtener de nuevo el fluido en sus condiciones iniciales, es decir, a baja presión y a baja temperatura. De esta forma se puede volver a iniciar el proceso.
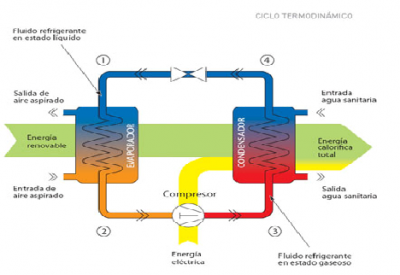
Por ejemplo, si queremos obtener calor en el interior de una vivienda, el condensador se colocará en el interior de la estancia y el evaporador fuera. Así se transferirá el frío de dentro de la vivienda hacia fuera, y el calor hacia el interior de la vivienda, de forma que la temperatura de la vivienda aumentará.
Como no sería práctico tener dos equipos, la mayoría de bombas de frío-calor incorporan una válvula de inversión de ciclo, que invierte el ciclo nombrado y permite obtener tanto calor como frío.
Implicaciones medio ambientales
Las gran ventaja medio ambiental que aportan las bombas de calor es la alta reducción de emisiones de CO2 a la atmosfera, aunque algunos de los refrigerantes usados por éstas pueden perjudicar la capa de ozono.
CO2
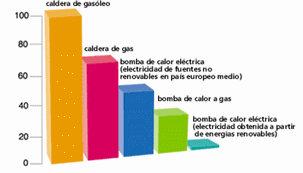
Uno de los gases que provoca el efecto invernadero es el CO2. Una gran cantidad de emisiones de este gas se atribuye a la producción y utilización de energía eléctrica, y las bombas de frío-calor contribuirán a su disminución. Las Bombas de Calor ofrecen una clara ventaja en relación con el medio ambiente, si las comparamos con otros equipos de calefacción convencional.
Tanto la bomba de calor eléctrica como la de gas, emiten menos CO2 que las calderas. El potencial actual que tienen las Bombas de calor para reducir las emisiones de CO2 de la Tierra es de un 6% del total, y este porcentaje aumenta considerablemente con el paso del tiempo. (Ver gráfico de arriba)
Refrigerantes
Determinados compuestos halogenados derivados de hidrocarburos saturados se emplean como refrigerantes en bombas de frío-calor. Algunos de estos compuestos son los CFC’s y los HCF’s, perjudiciales para la capa de ozono.
Como solución, se decidió a nivel mundial eliminarlos y sustituirlos por otros de tipo HFC’s semejantes pero inofensivos para la capa de ozono.
No obstante, actualmente en España se siguen utilizando bombas de calor que usan como refrigerante CFC’s y HCF’s.
Bibliografía
- es.wikipedia.org/wiki/Bomba_de_calor
- http://es.wikipedia.org/wiki/Leyes_de_la_termodinamica
- html.rincondelvago.com/bomba-de-calor_1.html
- http://www.empresaeficiente.com/es/catalogo-de-tecnologias/bomba-de-calor-industrial#ancla
- http://www.fisicanet.com.ar/fisica/termoestatica/ap03_termoestatica.php
- http://www.caloryfrio.com/200712262563/aire-acondicionado/bomba-de-calor-reversible/bomba-de-calor.html
- http://www.caloryfrio.com/calefaccion-y-agua-caliente/bomba-de-calor/bomba-de-calor.html
- http://enerxia.wordpress.com/energias-renovables-introduccion/energia-geotermica-breve-introduccion/geotermica-bomba-de-calor/
- http://www.angelfire.com/nc/naturclima/calor.html
- http://www.comerciallinas.com/Complepiscis/Bombacalor.htm
- Biologia 2º Bachillerato SM ’José Alcamí y Otros’
- Química Bachillerato Edebé
Ángel García Tudela / Jose Luis Pintado González 2ºA