REACCIONES IRREVERSIBLES Y REVERSIBLES
Las reacciones químicas son procesos en los que una o más sustancias (reactivos) se transforman en otra u otras con propiedades diferentes (productos).
REACCIONES IRREVERSIBLES
Una reacción irreversible es una reacción química que se verifica en un solo sentido, es decir, se prolonga hasta agotar por completo una o varias de las sustancias reaccionantes y por tanto la reacción inversa no ocurre de manera espontánea.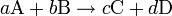
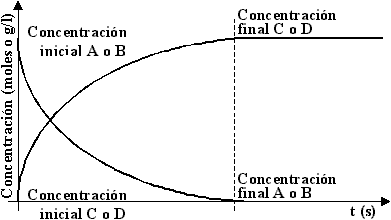
En estas reacciones la variación de entropía ocurre de tal manera que la entropía final es diferente a la inicial, por tanto, no se puede volver al estado inicial de entropía.
REACCIONES REVERSIBLES
Las reacciones reversibles son aquellas en las que los reactivos no se transforman totalmente en productos, ya que éstos vuelven a formar los reactivos, dando lugar así a un proceso de doble sentido que desemboca en equilibrio químico.
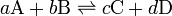
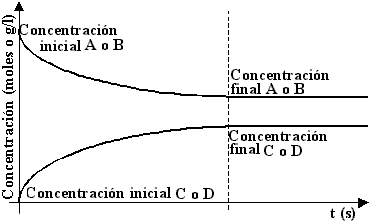
Este estado de equilibrio de una reacción reversible es el estado final del sistema en el que las velocidades de reacción directa e inversa son iguales (![]() ) y las concentraciones de las sustancias que intervienen permanecen constantes. Pero este estado es dinámico, ya que hay una incesante transformación química de las sustancias en los dos sentidos de la reacción, a pesar de que las concentraciones de reactivos y productos se mantengan constantes. Esto es así independientemente de las concentraciones iniciales, por lo que se establece un cociente entre las concentraciones de productos y reactivos en el equilibrio, a una temperatura dada, conocida como constante de equilibrio Kc (
) y las concentraciones de las sustancias que intervienen permanecen constantes. Pero este estado es dinámico, ya que hay una incesante transformación química de las sustancias en los dos sentidos de la reacción, a pesar de que las concentraciones de reactivos y productos se mantengan constantes. Esto es así independientemente de las concentraciones iniciales, por lo que se establece un cociente entre las concentraciones de productos y reactivos en el equilibrio, a una temperatura dada, conocida como constante de equilibrio Kc ( )
)
Pero cuando se trata de gases en equilibrio, hay que introducir la constante Kp, que expresa cuantitativamente la ley de equilibrio en función de las presiones parciales de los gases de la mezcla:
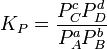
El equilibrio químico puede verse alterado, por lo que el sistema evoluciona hasta que se logra un nuevo estado de equilibrio bajo las nuevas condiciones. Esto es descrito por el principio de Le Chatelier que dice así:
"Una alteración externa de los factores que intervienen en un equilibrio induce un reajuste del sistema para reducir el efecto de dicha alteración y establecer un nuevo estado de equilibrio".
Estas alteraciones pueden ser por:
Cambios en las concentraciones
Si aumenta la concentración de una sustancia (A), el sistema se desplaza en el sentido en que se consume dicha sustancia, para así producir C y D, alcanzando el equilibrio.
Si disminuye la concentración de una sustancia (A), el sistema se desplaza en el sentido en que se produce dicha sustancia, ya que consumirá C y D para producir A y B, alcanzado el equilibrio.
Cambios de presión por variación de volumen
-Si aumenta la presión, el sistema se desplaza en el sentido en que hay disminución del número de moles de gas y, por tanto, de moléculas.
-Si disminuye la presión, el sistema se desplaza en el sentido en que hay aumento del número de moles de gas, y por tanto, de moléculas
Si el número de moléculas fuera el mismo en reactivos y productos, el cambio de volumen no afectaría al equilibrio.
Cambios de temperatura
-Si se proporciona calor al sistema, éste tiende a restablecer el estado de equilibrio absorbiendo el calor suministrado; para ello realizará preferentemente la reacción endotérmica. El sistema se desplazará hacia la izquierda.
-Si se absorbe calor del sistema disminuyendo la temperatura de éste, el sistema contrarrestará esta acción desprendiendo calor; para ello realizará la reacción exotérmica. El sistema se desplazará hacia la derecha.
En estas reacciones la variación de entropía es nula, ya que para que pueda producirse la reacción en ambos sentidos no puede haber una pérdida de trabajo en forma de calor puesto que no se podría realizar la reacción inversa de forma espontánea.
BIBLIOGRAFÍA:
www.wikipedia.com
http://www.sc.ehu.es/sbweb/fisica/estadistica/segundo/segundo.htm
http://galeon.hispavista.com/melaniocoronado/EQUILIBRIO.pdf
http://www.monografias.com/trabajos/termoyentropia/termoyentropia.shtml
http://www.fisicanet.com.ar/quimica/equilibrio_quimico/ap01_equilibrio_quimico.php
http://www.uclm.es/profesorado/jaorganero/subpaginas/apuntes/bases_quimicas_del_medio_ambiente/tema7.pdf
Libro de Edebé: Química 2º Bachillerato
7 comentarios
lucho -
LEl -
tu real camello princeso -
llklk -
alex -
Bastihan -
leyla -